LAG-3临床研究重大事件盘点
2018-07-05 · 医疗器械
PD-(L)1联合疗法靶点之LAG-3
在免疫抗癌疗法中,PD-1是无疑目前炙手可热的靶点,也是众多医药公司竞相追逐的目标。但由于PD-1对某些“冷”肿瘤的治疗效果不佳,研究者进而将研究重点转移到其他联合靶点的研究上,例如,TIM3, IDO-1, LAG-3等等。其中很有希望的靶点之一就是是拥有多个临床试验的靶点LAG-3。
LAG-3最初研究是为了寻求乙肝疫苗佐剂,而随着免疫抗癌疗法的兴起,LAG-3逐渐被认为一个颇有潜力的免疫检查点受体,目前在研的有10个靶向药物。而相关的19项注册的临床试验中,有15项是与PD-(L)1抗体联合用药,实力不容小觑。
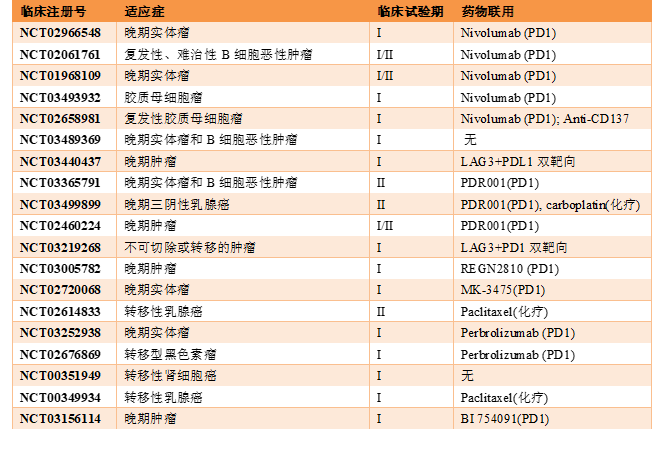
1 IMP321:可溶性LAG-3重组蛋白作为免疫激活剂
提到LAG-3,必须要谈Immutep SA 公司(详见推文:Immutep LAG-3免疫疗法的全球领跑者),其创始人正是LAG-3的发现者Frédéric Triebel。他在1990年首先发现LAG-3类似CD4,可结合MHC II类分子,从而抑制免疫反应。但在1999年与加拿大研究者的共同合作中,发现可溶性LAG-3竟然可以激活树突状细胞而促进免疫反应。随后便于2001年带领其团队创建了Immutep SA,致力研发LAG-3-Fc的临床价值。之后于2014年成功被Prima BioMed收购,仍然主推可溶性LAG-3重组蛋白IMP321 (eftilagimod alpha),作为抗原递呈细胞(APC)的激活剂,通过激活树突状细胞、CD8 T细胞而增进免疫反应。
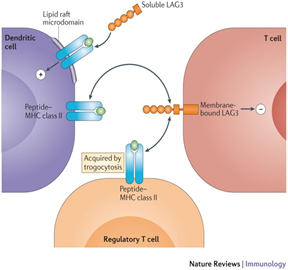
▲ 图片来源:
Nguyen L.T., et al (2015). “Clinical blockade of PD1 and LAG3 — potential mechanisms of action.” Nature Reviews Immunology volume15,pages45–56
IMP321有5项在研的临床试验,而且Immutep SA在今年ASCO大会上汇报了四项相关结果 (详见推文:LAG3+PD1:专家预测2018年最具潜力肿瘤免疫疗法之一)。从目前的临床结果来看,IMP321在体内可持续稳定地激活抗原递呈细胞和T细胞,联合紫杉醇作为一线药物治疗转移性乳腺癌的一期临床初见成效(临床试验注册号NCT02614833),虽然15名受试者中有9名出现严重副作用,但联合用药不仅增加体循环的免疫细胞数量,还提高了其活性和时间。二期正进入招募阶段,评估其无进展生存以及总生存和肿瘤反应、持续时间、病情稳固时间和生活质量等(临床试验注册号NCT02614833)。
不同于其他LAG-3单抗,IMP321不仅适合联合用药,也可以单独给药。一项一期临床的内容为研究IMP321不同给药途径的可行性和安全性,这为其直接注射到肿瘤块或腹膜间隙奠定临床基础。目前4名受试者尚未出现剂量限制性毒性。(临床试验注册号NCT03252938)
同时,IMP321联合Pembrolizumab(PD-1单抗),通过了对不可切除或转移性黑色素瘤的一期临床(临床试验注册号NCT02676869)。18名志愿者没有因为副反应退出治疗的,50%患者肿瘤减小,其中一例曾对Pembrolizumab单独治疗无效的患者被确认完全缓解。这无疑是对IMP321联合Pembrolizumab最好的预示。事实上,将免疫激动剂与PD-(L)1或CTLA-4等拮抗抗体结合,前景格外诱人,因为这是真正的免疫学机制-踩油门+松刹车。
2 联合拮抗LAG-3 和PD-1,协同增强免疫效应(LAG-525,BMS-986016,BI 754111,TSR-033和MK-4280)
除了仅有的可溶性LAG-3重组蛋白作为免疫激动剂,其他公司专注于LAG-3在免疫抑制方面的作用,纷纷研制不同的LAG-3单抗与PD-1单抗联合,抗击癌症。
一个颇具潜力的LAG-3靶向药物LAG-525 (IMP701),也是由Immutep S.A.研发。目前由诺华公司与Prima BioMed联合研发。为增加其免疫肿瘤学管线的多样化和深层次,更有抑制癌症的潜能,诺华公司广泛采用联合疗法进行尝试,其中备受关注的一组便是LAG-525和spartalizumab (PD-1单抗),3项相关临床试验中两项被今年ASCO收录,一项是治疗恶性肿瘤的一二期临床(临床试验注册号NCT02460224),121位采用联合用药的患者中有 11位部分缓解、1位完全缓解,证明患者对联合用药基本耐受并且其免疫系统得以调控。这对二期临床针对晚期实体瘤和血液恶性肿瘤的试验奠定很好的基础(临床试验注册号NCT03365791)。
而今年ASCO收录的最后一项关于LAG-3的汇报来自Regeneron 制药公司,旗下LAG-3单抗(REGN3767)单独使用或者联合Cemiplimab (REGN2810,PD-1单抗)正在进行针对晚期肿瘤的一期临床试验,评估其耐受性、药代动力学和免疫学参数(临床试验注册号NCT03005782)。
▲ 图片来源:
https://s21.q4cdn.com/104148044/files/doc_presentations/2017/ASCO-INVESTOR-DECK-final.pdf
除此以外,老牌医药公司Bristol-Myers Suibb百时美施贵宝公司的BMS-986016 (Relatlimab, LAG-3单抗)也值得一提。
目前它有5项临床试验,皆是与Nivolumab(Opdivo, PD-1单抗)的联合用药。虽然今年没有出现在ASCO大会上,但去年的汇报结果仍令大家记忆犹新。
这是目前LAG3 联合 PD-1的临床研究招募最多的一次,预计招募1000名,目前262例受试者的客观缓解率是11%,包括1例完全缓解,6例部分缓解。
更重要的是,Relatlimab改善了对PD-(L)1疗法产生耐药性的黑素瘤群体的治疗效果(临床试验注册号NCT01968109)。
结合其他临床前期结果 (临床试验注册号 NCT02966548,NCT02061761,NCT03493932,NCT02658981),BMS-986016联合Opdivo具有提高免疫效应的潜力,而且Relatlimab可以克服晚期黑色素瘤患者进行抗PD-(L)1治疗带来的耐药性。
Bohringer Ingelheim也不甘落后,2018年美国癌症研究协会(AACR)年会中,Bohringer Ingelheim也展示了BI 754111 (LAG-3单抗)与BI 754091(PD-1单抗)的临床前结果,此组合有助于恢复耗竭T细胞的功能,增强细胞干扰素的分泌,在小鼠MC-38肿瘤模型中40%得到完全缓解,且无副反应。这也让我们更加期待正在进行的联合BI 754111(LAG-3单抗)与BI 754091(PD-1单抗)治疗晚期癌症的一期临床试验(临床试验注册号NCT03156114)。
“免疫肿瘤学的突破性进展有望癌症治疗模式,而我们也在不断拓展这一领域,着重开发新的免疫肿瘤学方法的合理组合。”
肿瘤部主管Mehdi Shahidi博士
利用特有的体外体细胞超突变抗体探究技术平台,TESARO公司与AnaptysBio,Inc.合作开发了LAG-3单抗TSR-033。2017年5月1日,TESARO公司向美国FDA申请将TSR-033 (LAG-3单抗)纳入新药研究(IND)的队伍中。随后于8月份展开了TSR-033单独或联合PD-1单抗治疗多种晚期癌症的一期临床试验,评估其剂量限制性毒性、药代动力学及抗癌疗效(临床试验注册号NCT03250832)。
“TSR-033的IND是我们免疫肿瘤部在之前17个月内的第三个向FDA提交的申请。我们期待TSR-033,TSR-042(PD-1单抗)和TSR-022(TIM-3单抗)等免疫肿瘤候选药物可能成为多种肿瘤类型的治疗方案的基础。”
TESARO总裁兼首席运营官Mary Lynne Hedley博士
默克公司也研发了LAG-3单抗(MK-4280),正在投入针对晚期实体瘤的一期临床,MK-4280单独给药或联合 Pembrolizumab,预计招募340例患者,评估其安全性和药代动力学参数,并为二期临床提供剂量范围(临床试验注册号NCT02720068)。
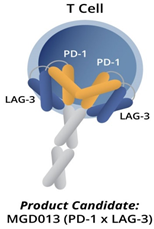
▲ 图片来源:
https://www.sec.gov/Archives/edgar/data/1125345/000112534517000041/mgnx-123116x10k.htm
3 双靶点药物(MGD013和FS118)同时拮抗LAG-3及PD-(L)1,效力持久
除了传统两种药物联用,MacroGenics公司利用其DART® (Dual-Affinity Re-Targeting,双亲和重新定位)分子,量身构建了MGD013,一个lgG4κ的双重特异的DART®分子,可独立或联合识别LAG-3和PD-1,阻断抑制信号,从而恢复T细胞效力。其优点在于血清半衰期延长,有广泛应用于多种癌症的潜能,包括实体瘤和血液恶性肿瘤。其一期临床是针对不可切除或转移的肿瘤进行计量递增的研究(临床试验注册号NCT03219268)。
无独有偶,F-star公司利用模块化抗体技术(Modular Antibody Technology™)研发了针对LAG-3和PD-L1双抗药物FS118,同时抑制两个免疫检查点受体活性,提高免疫活性。其一期临床于2018年2月启动,预计招募51例接曾受过PD-(L)1治疗的患者,评估其安全性、耐受性及药代动力学指标(临床试验注册号NCT03440437)。
4 结言
鉴于多项临床实验不约而同地联合使用LAG-3单抗和PD-1单抗,不难感受到海外企业对这对组合满腔期待;而目前的相对积极的临床结果也将向我们传递着积极的讯号。但是如同其他抗癌疗法,免疫联合疗法并不是万能的,针对特殊人群总归会有局限性;而从另一方面,这也是督促研究者们尽快找出相应的生物标记物,用来甄别合适人群。而且双药联用的一大顾忌就是药物的毒性和患者的耐受性,这也是临床实验的研究重点之一。
免疫联合疗法现在如火如荼地进行,但距离临床转化还有很长的路要走。美柏医健竭诚为大家带来详实可靠的医疗前沿咨询,也为投资人和医药企业提供有前景的合作机会,进而把一流医疗资源引进国内,便利国人。
参考资料:
1. PD-(L)1联合疗法产业图谱及靶点分析报告(即将上线,敬请关注)
2. https://www.clinicaltrials.gov/
3. American Society of Clinical Oncology (ASCO)官网
4. 美国癌症研究协会(AACR)官网
5. TESARO官网
6. Bohringer Ingelheim官网
7. MacroGenics官网
8. F-star官网


